M. Of. nr.
901 din 4 octombrie 2004
PARLAMENTUL ROMÂNIEI
CAMERA DEPUTAȚILOR SENATUL
L E G E
pentru
modificarea și completarea Legii nr. 178/2000 privind produsele cosmetice
Parlamentul României adoptă prezenta lege.
Art. I. Legea nr. 178/2000
privind produsele cosmetice, publicată în Monitorul Oficial al României, Partea
I, nr. 525 din 25 octombrie 2000, cu modificările și completările
ulterioare, se modifică și se completează după cum urmează:
1. La articolul 2,
litera a) va avea următorul cuprins:
a) produs cosmetic orice
substanță sau preparat care urmează să fie pus în contact cu diverse părți
externe ale corpului uman, precum piele, păr, unghii, buze, organe genitale
externe sau cu dinții și mucoasa bucală, cu scopul exclusiv sau principal de a
le curăța, a le parfuma, a le modifica aspectul și/sau a le corecta mirosurile
corporale și/sau a le proteja ori a le menține în bună stare;
2. La articolul 2,
după litera k) se introduc trei litere noi, literele l), m) și n), cu
următorul cuprins:
l) produs cosmetic
finit produsul cosmetic în formula sa finală, așa cum este
introdus pe piață și oferit consumatorului final, sau prototipul acestuia;
m) prototip primul
model sau design al unui produs cosmetic care nu a fost fabricat în loturi și
de la care produsul cosmetic finit este copiat sau dezvoltat;
n) perioada după
deschidere perioada de timp în care un produs cosmetic finit
poate fi folosit în siguranță, calculată din momentul primei deschideri a
ambalajului primar și începerii utilizării produsului.
3. Articolul 3 va
avea următorul cuprins:
Art. 3. Lista
cuprinzând categoriile de produse cosmetice, așa cum sunt definite în cuprinsul
art. 2 lit. a), este prevăzută în anexa nr. 1.
4. După articolul 3
se introduce un articol nou, articolul 31, cu următorul cuprins:
Art. 31. Ministerul Sănătății
reprezintă autoritatea națională competentă pentru reglementarea comercializării
produselor cosmetice, notificarea acestora în întocmirea și administrarea bazei
de date, inspecția și controlul pe piață, informarea populației, înregistrarea
cazurilor semnalate privind efectele adverse asupra populației, cauzate de
produsele cosmetice, raportarea către Comisia Europeană.
5. Articolul 4 va
avea următorul cuprins:
Art. 4. Produsele
cosmetice puse pe piață nu trebuie să pericliteze sănătatea umană atunci când
sunt folosite în condiții normale sau rațional previzibile de folosire, ținându-se
seama, în special, de prezentarea produsului, etichetarea, instrucțiunile privind
utilizarea și îndepărtarea acestuia, precum și de orice altă indicație prevăzută
de producător, de reprezentantul său autorizat sau de orice altă persoană
responsabilă pentru introducerea pe piață a produsului. Aceste indicații
nu vor scuti nici o persoană, în nici o circumstanță, de a se conforma cu alte
dispoziții ale prezentei legi.
6. După articolul 5
se introduc articolele 51 și 52 cu următorul cuprins:
Art. 51. (1) Fără
a se prejudicia îndeplinirea obligațiilor ce derivă din art. 4, se interzice:
a) introducerea pe piață
a produselor cosmetice în legătură cu formula finală, cât și a celor conținând
ingrediente sau combinații de ingrediente care, pentru a îndeplini cerințele
prezentei legi, au fost testate pe animale, folosindu-se o metodă, alta decât
cea alternativă, după data la care aceasta din urmă a fost validată și adoptată
la nivelul Uniunii Europene, ținându-se seama de evoluția procesului de
validare din cadrul Organizației pentru Cooperare și Dezvoltare Economică;
b) testarea pe animale
a produselor cosmetice finite, pentru a îndeplini cerințele prezentei legi;
c) testarea pe animale
a ingredientelor sau combinațiilor de ingrediente, pentru a îndeplini cerințele
prezentei legi, începând cu data la care aceste teste trebuie să fie înlocuite
de metodele alternative validate sau stabilite de către Comisia Europeană. Metodele
alternative sunt prevăzute în anexa nr. 3 la Normele metodologice de
aplicare a Ordonanței de urgență a Guvernului nr. 200/2000 privind
clasificarea, etichetarea și ambalarea substanțelor și preparatelor chimice
periculoase, aprobate prin Hotărârea Guvernului nr. 490/2002.
(2) Ministerul Sănătății
asigură, prin ordin al ministrului, preluarea noilor metode alternative, în
acord cu progresul realizat în validarea și adoptarea acestora de către Comisia
Europeană, în conformitate cu următoarele termene limită: 11 martie 2009,
pentru testarea ingredientelor sau combinațiilor de ingrediente, și 11 martie
2013, pentru testele de toxicitate cu doză repetată, toxicitate reproductivă și
toxicocinetică.
(3) În situații excepționale,
atunci cînd există un motiv întemeiat în ceea ce privește siguranța unui
ingredient cosmetic existent, Ministerul Sănătății poate solicita Comisiei
Europene să acorde o derogare de la prevederile alin. (1). Cererea de
derogare trebuie să conțină o evaluare a situației și să indice măsurile
necesare. Pe baza cererii și după consultarea Comitetului Științific
pentru Cosmetice și Produse Nealimentare, Comisia Europeană poate autoriza
derogarea prin decizie motivată. Această autorizare trebuie să conțină
condițiile în care s-a acordat derogarea, obiectivul specific, durata și
raportarea rezultatelor.
(4) Derogarea poate fi
acordată numai dacă:
a) ingredientul se
folosește în mod frecvent și nu poate fi înlocuit de un alt ingredient cu funcție
similară;
b) problema de sănătate
umană specifică este fundamentată și nevoia de a recurge la testări pe animale
este justificată și susținută de un protocol de cercetare detaliat, propus ca
bază de evaluare.
Art. 52. (1) Este
interzisă folosirea în produsele cosmetice a substanțelor clasificate ca fiind
cancerigene, mutagenice sau toxice pentru reproducere, din categoriile 1, 2 și
3, așa cum sunt prevăzute în anexa nr. 2 la Normele metodologice de
aplicare a Ordonanței de urgență a Guvernului nr. 200/2000 privind
clasificarea, etichetarea și ambalarea substanțelor și preparatelor chimice
periculoase.
(2) O substanță
clasificată în categoria 3 poate fi folosită în produsele cosmetice numai dacă
a fost evaluată de Comitetul Științific pentru Cosmetice și Produse
Nealimentare al Comisiei Europene și a fost acceptată pentru a fi folosită în
produse cosmetice.
7. După articolul 6
se introduce articolul 61 cu următorul cuprins:
Art. 61. (1) Prin
derogare de la prevederile art. 5 și fără a aduce atingere prevederilor
Ordinului ministrului industriei și resurselor și al ministrului sănătății și
familiei nr. 309/729/2001 privind inventarul pentru ingredientele folosite
în produsele cosmetice, publicat în Monitorul Oficial al României, Partea I, nr. 756
din 28 noiembrie 2001, Ministerul Sănătății poate autoriza folosirea pe
teritoriul României a substanțelor care nu sunt prevăzute în lista de substanțe
permise pentru anumite produse cosmetice, în următoarele condiții:
a) autorizarea trebuie
să se limiteze la o perioadă maximă de 3 ani;
b) să se efectueze o
verificare oficială a produselor cosmetice care conțin substanța sau preparatul
a cărui utilizare a fost autorizată;
c) produsul cosmetic
astfel fabricat trebuie să poarte o indicație distinctă, care va fi precizată în
autorizație.
(2) Ministerul Sănătății
trebuie să informeze Comisia Europeană și statele membre despre decizia de
autorizare luată conform alin. (1), în decurs de două luni de la data intrării
în vigoare a autorizației.
(3) Înainte de
expirarea termenului de 3 ani, prevăzut la alin. (1) lit. a),
Ministerul Sănătății poate înainta Comisiei Europene o cerere pentru includerea
pe lista substanțelor permise a substanței care a primit autorizarea națională,
conform alin. (1). Concomitent va comunica documentația pe care se întemeiază
această cerere și va indica utilizările cărora le este destinată substanța.
8. La articolul 8,
partea introductivă va avea următorul cuprins:
Art. 8. Notificarea
constă în transmiterea, în formă scrisă și/sau electronică, a următoarelor
date:
9. Alineatele (1) și
(3) ale articolului 9 vor avea următorul cuprins:
Art. 9. (1) Notificarea
unui produs cosmetic care se introduce pe piață pe teritoriul României se face la
Ministerul Sănătății, prin transmiterea în formă scrisă și/sau electronică a
formularului de notificare. Ministerul Sănătății înregistrează
notificarea, comunică celui care a transmis-o numărul notificării și face
publică lista produselor cosmetice notificate.
.......................................................................................
(3) Orice modificare a
informațiilor transmise Ministerului Sănătății, conform prevederilor art. 8,
va fi adusă la cunoștință acestuia în termen de 30 de zile de la data apariției
modificării.
10. La articolul 10
alineatul (1), literele b), d), e) și f) vor avea următorul cuprins:
b) specificațiile
fizico-chimice și microbiologice pentru materiile prime și produsul finit și
criteriile de control de puritate și microbiologie pentru produsul cosmetic;
........................................................................................
d) numele persoanei
responsabile cu fabricarea sau importul pentru prima dată al unui produs
cosmetic în Uniunea Europeană; persoana responsabilă trebuie să posede un nivel
adecvat de calificare profesională sau experiență, în conformitate cu legislația
și practica statului membru al Uniunii Europene unde sunt fabricate sau unde
sunt prima dată importate produsele cosmetice;
e) evaluarea riscului
pentru sănătatea umană al produsului cosmetic. Pentru aceasta fabricantul
va ține seama de profilul toxicologic general al ingredientelor folosite, de
structura lor chimică și de nivelul de expunere, în special de caracteristicile
de expunere specifice zonei în care produsul va fi aplicat sau de populația căreia
îi este destinat; pentru produsele destinate copiilor sub 3 ani, precum și
pentru cele destinate exclusiv igienei intime externe trebuie să existe o
evaluare specifică a securității pentru sănătatea umană. În cazul în care
produsul se fabrică în diferite localități pe teritoriul României sau al
statelor membre ale Uniunii Europene, producătorul poate să aleagă o singură
locație/loc, unde informațiile privind produsul sunt disponibile. În acest
sens, la solicitarea autorităților competente pentru monitorizarea produsului
sau a altor autorități cu competențe de control, producătorul este obligat să
precizeze adresa la care informațiile sunt rapid accesibile;
f) numele și adresa
persoanelor calificate responsabile, care au evaluat produsul din punctul de
vedere al siguranței pentru sănătatea umană; persoanele responsabile pentru
evaluare trebuie să aibă diplomă de studii superioare în specialitățile:
farmacie, toxicologie, dermatologie, medicină sau o specialitate similară, așa
cum este definită în cuprinsul Legii nr. 200/2004 privind recunoașterea
diplomelor și calificărilor profesionale pentru profesiile reglementate din România.
11. La articolul 10
alineatul (1), după litera h) se introduce litera i) cu următorul
cuprins:
i) informații privind
orice testări pe animale, efectuate de producător, agenții sau furnizorii săi,
legate de dezvoltarea produsului sau de evaluarea siguranței produsului
cosmetic ori a ingredientelor sale, inclusiv orice testare pe animale, efectuată
în scopul respectării unor reglementări naționale din țările care nu sunt
membre ale Uniunii Europene.
12. La articolul 10,
după alineatul (2) se introduc alineatele (3) și (4) cu următorul
cuprins:
(3) Fără a se aduce
prejudicii protejării secretului comercial și proprietății intelectuale, producătorul,
reprezentantul său autorizat, beneficiarul fabricării produsului cosmetic sau
persoana responsabilă cu introducerea pe piață a unui produs cosmetic importat
va asigura ca informația prevăzută la alin. (1) lit. a) și
g) să fie accesibilă publicului în orice format, inclusiv electronic;
informațiile prevăzute la alin. (1) lit. a), care vor fi
accesibile publicului, vor fi limitate la informațiile cantitative ale substanțelor
periculoase reglementate prin Ordonanța de urgență a Guvernului nr. 200/2000
privind clasificarea, etichetarea și ambalarea substanțelor și preparatelor
chimice periculoase, aprobată cu modificări și completări prin Legea nr. 451/2001.
(4) Evaluarea siguranței
pentru sănătatea umană, așa cum este prevăzută la art. 10 alin. (1) lit. e),
va fi efectuată în conformitate cu principiile de bună practică de laborator
prevăzute de Hotărârea Guvernului nr. 63/2002 privind aprobarea
Principiilor de bună practică de laborator, precum și inspecția și verificarea
respectării acestora în cazul testărilor efectuate asupra substanțelor
chimice.
13. La articolul 13,
partea introductivă a alineatului (1), literele a), b), c), e), f) și i) și
alineatul (2) vor avea următorul cuprins:
Art. 13. (1) Produsele
cosmetice pot fi puse pe piață numai dacă pe recipient și pe ambalaj informațiile
următoare sunt inscripționate vizibil, lizibil și cu caractere care nu se șterg
ușor; în ceea ce privește informațiile prevăzute la lit. i), acestea pot
fi inscripționate doar pe ambalaj. Se vor indica următoarele date:
a) numele sau denumirea
producătorului ori a persoanei responsabile cu introducerea pe piață stabilite în
Uniunea Europeană sau abrevierea, dacă aceasta permite identificarea
persoanelor respective;
b) sediul sau adresa
din statul membru al Uniunii Europene a producătorului sau a persoanei
responsabile pentru introducerea pe piață în Uniunea Europeană a unui produs
cosmetic importat sau abrevierea sa, atât timp cât aceasta este posibil de
identificat;
c) țara de origine pentru produsele fabricate în afara statelor membre ale Uniunii Europene;
........................................................................................
e) data de minimă durabilitate
indicată prin sintagma «A se folosi preferabil înainte de...», urmată de dată
sau de indicarea locului de pe ambalaj unde se află inscripționată această dată. Data
trebuie clar menționată, indicându-se, în ordine și cu cifre arabe, fie luna și
anul, fie ziua, luna și anul. Dacă este necesar, această informație va fi
suplimentată de o indicare a condițiilor care trebuie îndeplinite pentru a se
garanta durabilitatea afirmată. Indicarea datei de durabilitate nu este
obligatorie pentru produsele cosmetice a căror durabilitate minimă depășește 30
de luni. Pentru acestea mențiunile se completează cu indicarea perioadei,
după deschiderea produsului cosmetic, în care poate fi folosit în siguranță de
către consumatori. Această informație va fi redată prin simbolul prevăzut în
anexa nr. 2, urmat de perioada de utilizare exprimată în luni și/sau ani;
f) precauțiunile
speciale la utilizare, în special cele referitoare la ingredientele menționate în
listele prevăzute la art. 6 alin. (1) și aprobate prin ordin al
ministrului sănătății și care trebuie inscripționate pe ambalaj, precum și
informațiile speciale de avertizare pentru produsele cosmetice de uz
profesional, în special cele pentru coafură. În situația în care acest
lucru nu este posibil din motive practice, va fi alăturat un prospect, o
banderolă ori un cartonaș care va conține informațiile necesare consumatorilor,
fie abreviat, fie prin utilizarea simbolului prevăzut în anexa nr. 3, care
trebuie să figureze pe recipient și pe ambalaj;
........................................................................................
i) lista cuprinzând
ingredientele care fac parte din compoziția produsului cosmetic, în ordinea
descrescătoare a greutății în momentul încorporării lor; această listă este
precedată de cuvântul ingrediente. În cazul în care, din motive
practice legate de spațiu, acest lucru nu este posibil, va fi alăturat un
prospect, o banderolă ori un cartonaș ce trebuie să conțină informația necesară
consumatorului și va fi inscripționată pe recipient ori pe ambalaj informația
abreviată ori simbolul prevăzut prin ordin al ministrului sănătății. Se
vor menționa ingredientele în concentrație mai mică de 1%, fără o ordine anume,
după cele a căror concentrație este mai mare de 1%. Coloranții se pot menționa
după celelalte ingrediente. Pentru produsele cosmetice decorative
comercializate în mai multe culori/nuanțe se menționează toți agenții de
colorare folosiți, precedați de sintagma poate conține sau de simbolul
+/-. Compozițiile de parfumare sau de aromatizare și materiile lor prime
vor fi menționate prin cuvântul parfum, respectiv aromă. Substanțele
cuprinse în listele prezentate la art. 6 alin. (1) lit. a) și
aprobate prin ordin al ministrului sănătății, pentru care există mențiunea de a
fi inscripționate pe ambalaj, vor fi incluse pe lista ingredientelor,
indiferent de funcțiunea pe care o au în produsul cosmetic.
(2) Acolo unde, din
motive practice legate de dimensiunea sau de forma recipientelor ori a
ambalajelor, nu este realizabilă inscripționarea informațiilor prevăzute la
alin. (1) lit. f) și i), acestea se înscriu pe o etichetă,
o banderolă, un prospect sau un pliant care este alăturat produsului. În
cazul săpunului, al bilelor pentru baie sau al altor produse de dimensiuni
mici, unde este practic imposibil, din motive de dimensiune sau formă, să fie
scrise informațiile prevăzute la alin. (1) lit. i) pe un
prospect, o etichetă, o banderolă, un pliant sau un cartonaș atașat, aceste
informații vor fi scrise pe un pliant pus în imediata vecinătate a
recipientului în care produsul cosmetic este expus spre vânzare.
14. La articolul 13,
după alineatul (2) se introduce alineatul (3) cu următorul cuprins:
(3) Pentru produsele
cosmetice care nu sunt preambalate și care sunt ambalate la punctul de vânzare
la cererea cumpărătorului ori care sunt preambalate pentru imediata vânzare,
regulile detaliate pentru modul de indicare a informațiilor prevăzute la alin. (1) se
aprobă prin ordin al ministrului sănătății, care se publică în Monitorul
Oficial al României, Partea I.
15. După articolul
14 se introduce articolul 141 cu următorul cuprins:
Art. 141. (1) Ministerul
Sănătății nu poate interzice, restrânge sau împiedica introducerea pe piață a
produselor cosmetice care îndeplinesc cerințele prevăzute de prezenta lege.
(2) În vederea asigurării
unui tratament medical prompt și adecvat în cazul unor situații cu risc pentru
sănătate, la solicitarea Ministerului Sănătății, producătorul, importatorul sau
persoana responsabilă cu introducerea pe piață trebuie să asigure furnizarea
informațiilor necesare și adecvate privind substanțele folosite în produsele
cosmetice.
(3) Ministerul Sănătății
este autoritatea națională competentă care asigură transmiterea informațiilor
prevăzute la alin. (2) către oricare dintre statele membre ale
Uniunii Europene, la solicitarea acestora, luând măsurile necesare pentru ca
informația să fie transmisă doar în scopul aplicării unui tratament medical
adecvat.
16. Articolul 15 va
avea următorul cuprins:
Art. 15. (1) În
etichetare, prezentarea spre vânzare sau promovarea produsului se interzice întrebuințarea
textelor, denumirilor, mărcilor, imaginilor sau a altor însemne care atribuie
produselor caracteristici pe care acestea nu le au.
(2) Producătorul ori
persoana responsabilă cu introducerea pe piață a produsului poate menționa, pe
ambalaj sau pe orice alt document, nota, eticheta, banderola ce însoțește ori
care se referă la produs, că produsul nu a fost testat pe animale, numai dacă
producătorul sau furnizorul său de materii prime nu a efectuat testări pe
animale pentru produsul final ori pentru prototip sau nu a folosit nici un
ingredient testat pe animale de către terțe persoane, în scopul formulării de
produse cosmetice noi.
17. La articolul 17,
partea introductivă și litera c) vor avea următorul cuprins:
Art. 17. Constituie
contravenții și se sancționează cu amendă următoarele fapte:
............................................................................................
c) nerespectarea
prevederilor art. 4, 5, 51, 52, 7, art. 141 alin. (2) și ale
art. 19, cu amendă de la 50.000.000 lei la 100.000.000 lei.
18. Articolul 19 va
avea următorul cuprins:
Art. 19. În
cazul în care Ministerul Sănătății constată, pe baza unor dovezi întemeiate, că
un produs cosmetic, deși respectă cerințele prezentei legi, reprezintă un
pericol pentru sănătate, poate interzice provizoriu comercializarea acelui
produs sau poate impune condiții speciale pentru comercializarea acestuia pe
teritoriul României. În acest caz va informa imediat Comisia Europeană și
statele membre ale Uniunii Europene asupra acestei decizii și asupra motivelor
care au fundamentat această decizie.
19. După articolul
20 se introduc articolele 201 și 202 cu următorul cuprins:
Art. 201. (1) Ministerul
Sănătății este autoritatea națională competentă, care transmite informații
Comisiei Europene referitoare la dispozițiile art. 8 și 10, în scopul
publicării în Jurnalul Oficial al Comunităților Europene.
(2) Ministerul Sănătății
asigură cooperarea cu autoritățile competente ale statelor membre, pentru
aplicarea dispozițiilor prezentei legi.
Art. 202. În cazul în
care Ministerul Sănătății a decis, potrivit art. 19, interzicerea
provizorie sau restricționarea comercializării unui produs cosmetic, acesta
informează în scris, în termen de 72 de ore, partea interesată/implicată despre
această măsură, indicând motivele deciziei și măsurile de remediere
recomandate, în conformitate cu reglementările legale existente, precum și data
limită până la care acestea pot fi aplicate.
20. Articolul 21 va
avea următorul cuprins:
Art. 21. Prevederile
art. 17 se completează cu dispozițiile Ordonanței Guvernului nr. 2/2001
privind regimul juridic al contravențiilor, aprobată cu modificări și completări
prin Legea nr. 180/2002, cu modificările ulterioare.
21. După articolul
22 se introduc articolele 221 și 222 cu următorul cuprins:
Art. 221. Ministerul Sănătății
va stabili, până la data de 31 decembrie 2006, procedura prin care unele
substanțe și preparate chimice pot fi autorizate temporar, pentru a fi
utilizate în produsele cosmetice, mecanismul de acces la informațiile despre
substanțele folosite în fabricarea produselor cosmetice necesare pentru
asigurarea tratamentelor medicale adecvate în cazul unor situații cu risc
pentru sănătate, care se aprobă prin ordin al ministrului sănătății.
Art. 222. Prevederile
prezentei legi nu se aplică produselor care conțin substanțe prevăzute în anexa
nr. 6 la Ordinul ministrului sănătății și familiei nr. 1.031/2002
pentru aprobarea listelor cuprinzând substanțele ce pot fi utilizate în compoziția
produselor cosmetice, publicat în Monitorul Oficial al României, Partea I, nr. 17
din 14 ianuarie 2003, cu modificările ulterioare.
23. După articolul
25 se introduce articolul 26 cu următorul cuprins:
Art. 26. Anexele
nr. 13 fac parte integrantă din prezenta lege.
24. Anexele nr. 1
și 2 vor avea următorul cuprins:
ANEXA
Nr. 1
L I S T A
cuprinzând categoriile de produse
cosmetice
Creme, emulsii, loțiuni,
geluri și uleiuri pentru piele (mâini, față, picioare etc.)
Măști pentru față (cu
excepția produselor care acționează ca abrazive superficiale ale pielii pe cale
chimică)
Baze nuanțatoare
(lichide, paste, pudre etc.)
Pudre de machiaj,
pudre după baie, pudre igienice etc.
Săpunuri de toaletă,
săpunuri deodorante etc.
Parfumuri, ape de
toaletă, ape de colonie etc.
Preparate pentru baie
și duș (săruri, spume, uleiuri, geluri etc.)
Depilatoare
Deodorante și
antiperspirante
Produse pentru îngrijirea
părului:
nuanțatoare și decolorante;
produse pentru ondulare, îndreptare
și fixare;
produse pentru aranjare
(decorare);
produse pentru curățare (loțiuni,
pudre, șampoane etc.);
produse de condiționare (loțiuni,
creme, uleiuri etc.);
produse de coafare (loțiuni,
lacuri, briantine etc.)
Produse pentru ras
(creme, spume, loțiuni etc.)
Produse pentru
machiaj și îndepărtarea acestuia de pe față și ochi
Produse destinate
aplicării pe buze
Produse pentru îngrijirea
dinților și a gurii
Produse pentru îngrijirea
unghiilor și decorarea lor
Produse pentru igiena
intimă externă
Produse pentru băi de
soare (plajă)
Produse pentru
bronzare fără soare
Produse de albire a
pielii
Produse antirid.
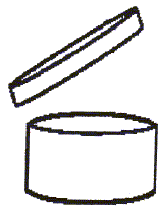
ANEXA Nr. 2 *)
Simbolul pentru indicarea perioadei
după deschidere
25. După anexa nr. 2
se introduce anexa nr. 3 cu următorul cuprins:
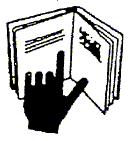
ANEXA
Nr. 3 1)
Simbolul pentru precauțiunile
particulare de utilizare
Art. II. Limitele de competență în
efectuarea controlului pe piață al produselor cosmetice se stabilesc prin ordin
comun al ministrului sănătății și al președintelui Autorității Naționale pentru
Protecția Consumatorilor, în termen de 180 de zile de la publicarea prezentei
legi.
Art. III. Prezenta lege transpune
Directiva Consiliului nr. 76/768/CEE referitoare la produsele cosmetice,
publicată în Jurnalul Oficial al Comunităților Europene nr. L053 din 25
februarie 1977, cu modificările și completările ulterioare, inclusiv cu cele
aduse prin Directiva nr. 2003/15/CE, publicată în Jurnalul Oficial al
Comunităților Europene nr. L066 din 11 martie 2003.
Art. IV. Dispozițiile prezentei legi
intră în vigoare la 3 zile de la data publicării în Monitorul Oficial al României,
Partea I, cu excepția:
a) dispozițiilor art. I
pct. 8 și 9, care intră în vigoare la 180 de zile de la data publicării
legii;
b) dispozițiilor art. I
pct. 6, 7 și 1019, care intră în vigoare la data aderării României la
Uniunea Europeană.
Art. V. Legea nr. 178/2000 privind
produsele cosmetice, cu modificările și completările ulterioare, precum și cu
cele aduse prin prezenta lege, se va republica în Monitorul Oficial al României,
Partea I, dându-se textelor o nouă numerotare.
Această lege a fost
adoptată de Parlamentul României, cu respectarea prevederilor art. 75 și
ale art. 76 alin. (2) din Constituția României, republicată.
|
PREȘEDINTELE
CAMEREI DEPUTAȚILOR VALER DORNEANU |
PREȘEDINTELE
SENATULUI NICOLAE VĂCĂROIU |
București, 28 septembrie 2004.
Nr. 379.